Sustitución nucleófila aromática
La sustitución nucleófila aromática es una herramienta sumamente útil para la funcionalización de los compuestos arílicos. Esta herramienta se puso en práctica a comienzos de la década de 1950 y aún es muy frecuente en la práctica de la síntesis orgánica, aunque métodos más modernos para acoplar nitrógeno y carbón aromático, como el acoplamiento cruzado de Buchwald-Hartwig han ganado popularidad durante la última década.
Al igual que con todas las reacciones de sustitución, un nucleófilo como una amina o un alcohol desplaza un grupo saliente en el anillo aromático, este generalmente es un haluro.
Existen diferentes mecanismos asociados con la sustitución nucleófila aromática. Solamente tres tienen relevancia práctica en la síntesis orgánica:
- Mecanismo de adición y eliminación
- Mecanismo de bencino
- SN1 aromático de sales de diazonio
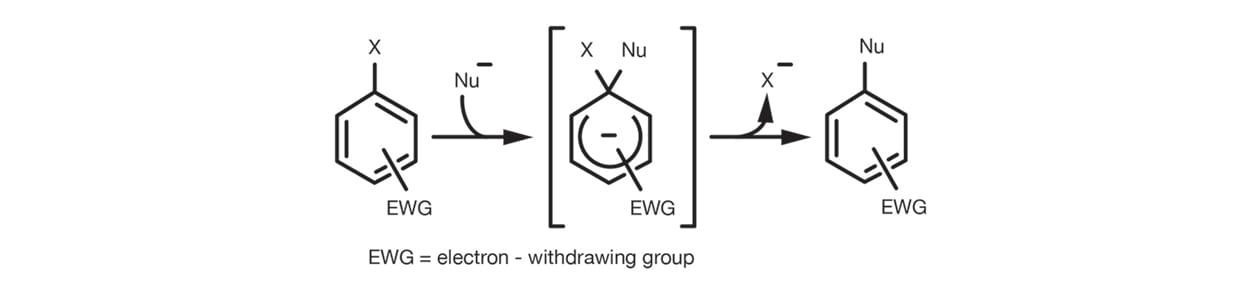
El SNAr a través del mecanismo de adición y eliminación es la reacción más frecuente, que se produce en el caso de los haluros de arilo sustituidos. El efecto de eliminación de electrones del sustituyente facilita la adición del nucleófilo en el anillo al establecer los intermediarios de carga negativa antes de la eliminación del grupo saliente.
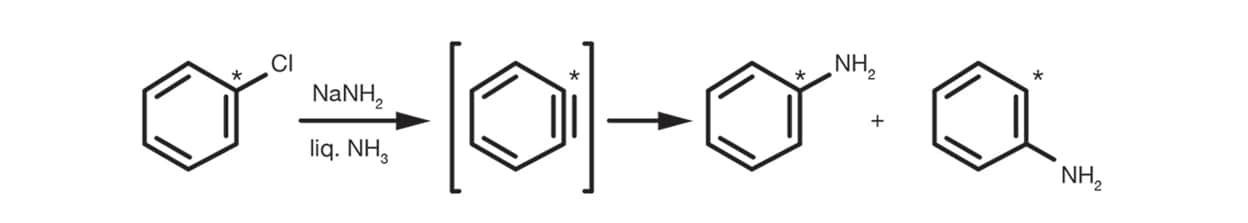
El mecanismo de bencino es importante para los haluros de arilo no sustituidos y procede a través de un intermediario de bencino como se indica en el esquema siguiente.
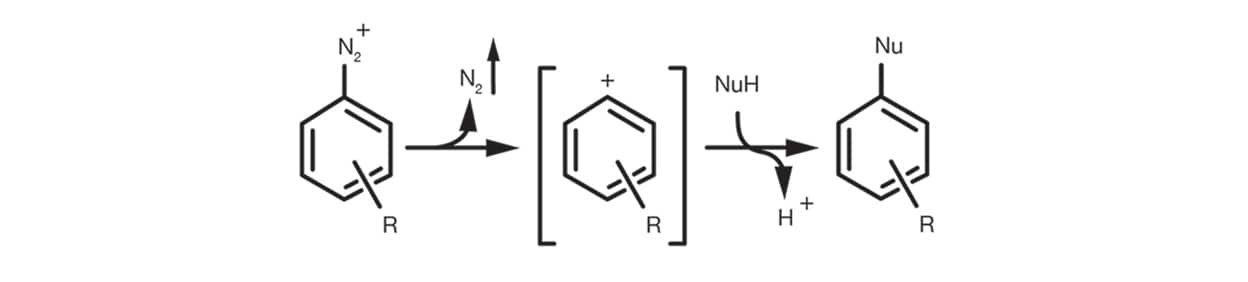
Finalmente, el SN1 aromático se produce en el caso de las sales de diazonio aromáticas a través de la formación de un catión de arilo intermediario mediante la eliminación de N2 y la posterior adición del nucleófilo para generar el producto sustituto.
La configuración de las reacciones es bastante simple. Generalmente, se lleva a cabo en disolventes orgánicos relativamente polares, próticos y apróticos, como DMSO, etanol, DMF, NMP. Está respaldado por el uso de una base auxiliar (los más frecuentes son lasaminas terciarias y los carbonatos) y es infrecuente que necesite excesos importantes de nucleófilos.
Protocolos de reacción de referencia
1.
Pese cantidades equimolares de un haluro de arilo y una amina (5-50 mmol). Añada 1,5-2 equivalentes de carbonato de potasio (o base alternativa) en etanol. Caliente hasta obtener un reflujo durante 8-24 h.
Generalmente, los derivados de anilina pueden precipitarse mediante un cambio de pH.
2.
Pese cantidades equimolares de haluro de arilo y alcohol, disuelva en THF y suspenda 1,5 equivalentes de hidróxido sódico. Agite durante 8-24 h. La reacción puede llevarse a cabo a temperatura ambiente; sin embargo, a menudo es necesario calentarla a 80-100 °C.
Los productos de éter suelen separarse mediante extracción con agua y disolventes polares o apolares. Es frecuente el uso de sulfato de magnesio para quitar agua y de vacío para eliminar volátiles.
Los tioles pueden usarse eficazmente como nucleófilos y el protocolo de reacción es generalmente el mismo que para los alcoholes.
3.
Disuelva el haluro de arilo, un leve exceso de cianuro de potasio (1,1-1,3 equivalentes) y una cantidad equimolar de trimetilamina en DMSO. Agite la reacción a aproximadamente 50 °C durante 12-24 h añadiendo agua en gotas.
Los productos de reacción pueden diluirse en agua y extraerse con acetato de etilo u otros disolventes apróticos polares.
Con frecuencia, suele ser necesaria una purificación cromatográfica.
Ejemplos
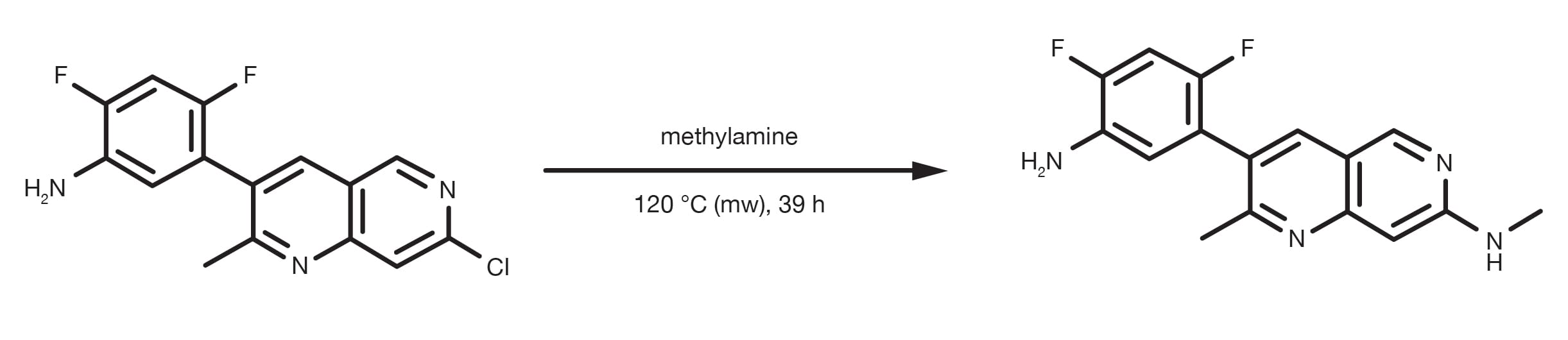
Referencia de patente: WO2013134298
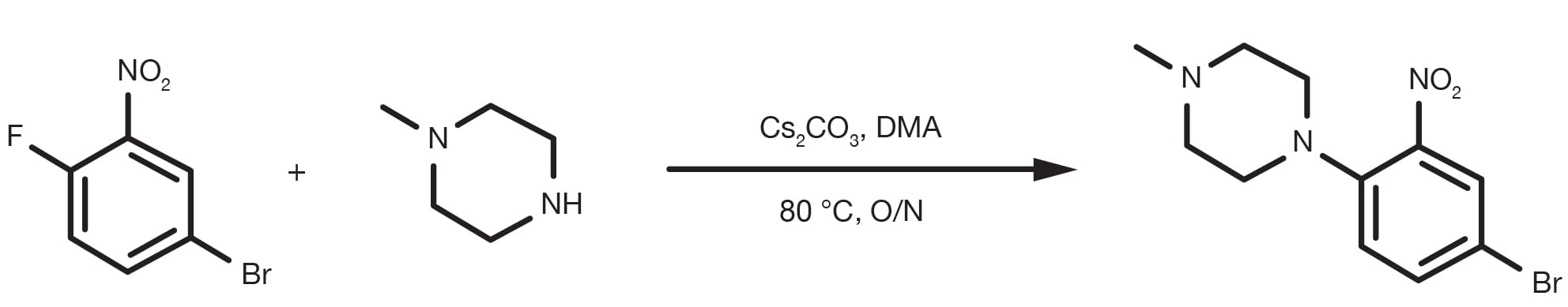
Referencia de patente: WO2014149164
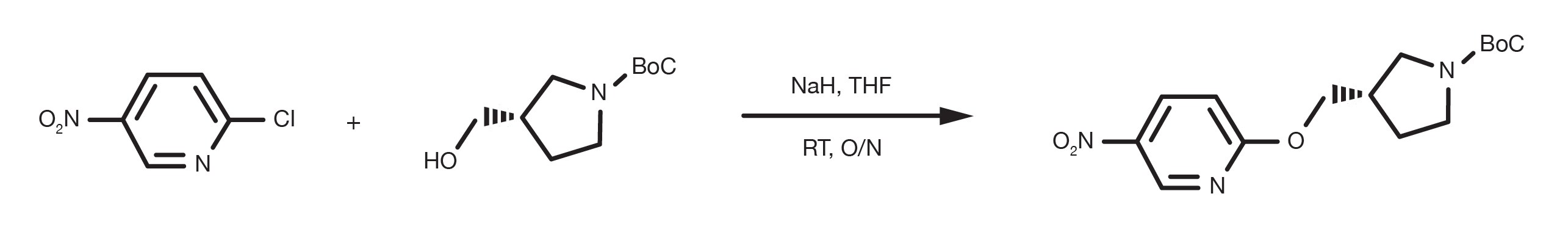
Referencia de patente: WO2016012477
Referencias bibliográficas clave
- Chem. Rev., 1951, 49 (2): 273–412. https://doi.org/10.1021/cr60153a002
- Molecules 2006, 11, 130-133. https://doi.org/10.3390/11020130
Selección del producto
Disolventes:
Ingredientes y aditivos básicos:
Bases:
Terc-butóxido de potasio sólido
Terc-butóxido de potasio, solución
1,4-diazabiciclo[2.2.2]octano (DABCO)
Catalizadores:
Se puede usar gel de sílice como catalizador en algunas reacciones de alta temperatura de clorobenceno no sustituido
Componentes básicos:
haluros arilo (poli)sustituidos:
Haluros n-heteroarílicos:
Sales de diazonio (hetero)arílicas:
4-nitrobencenodiazonio tetrafluoroborato
4-metoxibencenodiazonio tetrafluoroborato
4-bromobencenodiazonio tetrafluoroborato
Nucleófilos:
aminas (primarias, secundarias y terciarias)
Otras aminas aromáticas primarias
Otras aminas alquílicas primarias
Alcoholes alifáticos primarios
Alcoholes alifáticos secundarios
Alcoholes aromáticos (fenoles sustituidos de diferentes formas):
Tioles:
Otros nucleófilos: