Producción a gran escala de vectores lentivirales mediante transfección transitoria
Por Matthew Weston
Qué son los vectores lentivirales
Los vectores lentivirales (LV) se utilizan para la transferencia de genes en aplicaciones de terapia celular y génica.[1] Se ha demostrado que son seguros y eficaces para su uso en tratamientos clínicos y, a fecha de 2022, se empleaban en más de 100 ensayos clínicos en curso en todo el mundo para la modificación ex vivo de células o la terapia in vivo. [2] De hecho, como resultado de esta popularidad y de la reciente aprobación de determinadas terapias CAR-T, se prevé que el mercado de producción de LV crezca hasta los 800 millones de dólares en 2026.[3] Entre las áreas de tratamiento destacables se incluyen enfermedades hereditarias como la ß-talasemia[4] o la enfermedad de Parkinson.[5]
"Como resultado de esta popularidad de los ensayos clínicos y de la reciente aprobación de ciertas terapias CAR-T, se prevé que el mercado de la producción de LV crezca hasta los 800 millones de dólares en 2026."
La necesidad de ampliación
Al mismo tiempo que ha aumentado el uso de LVs en nuevas terapias, también lo ha hecho la necesidad de tecnologías que puedan ayudar a aumentar su fabricación. En la actualidad, la producción a gran escala de LVs se consigue generalmente amplificando directamente los métodos de producción a pequeña escala, por ejemplo ampliando la superficie de cultivo mediante la adición de unidades de cultivo/producción suplementarias (o "scaling-out").
Por lo tanto, existe un interés considerable en determinar la mejor configuración de equipos para una producción óptima, y XIAOFAN Y RUI han estudiado la producción de LV utilizando el recipiente de cultivo celular Corning™ HYPERStack™,[1] que cuenta con la tecnología High Yield PERformance (HYPER) patentada por Corning. En su informe se utilizan tres recipientes Corning™ con fines comparativos: un matraz de superficie T-25 CellBIND™, una cámara de cultivo CellBIND™ CellSTACK™ de 2 capas y un recipiente de cultivo celular HYPERStack™ de 12 capas.
"En la actualidad, la producción a gran escala de LV se consigue generalmente amplificando directamente los métodos de producción a pequeña escala, por ejemplo ampliando la superficie de cultivo mediante la adición de unidades de cultivo/producción suplementarias (o scaling-out)."
Comparación de recipientes de cultivo celular
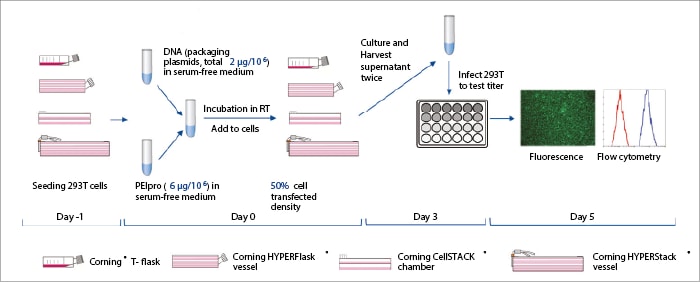
Las células 293T (ATCC CRL-3216) se cultivaron en medio Eagle modificado de Dulbecco (DMEM) con suero bovino fetal (FBS) y un antibiótico/antimicótico, se sembraron en los frascos de comparación y se cultivaron durante la noche antes de la transfección. Se preparó un sistema de ADN de tres plásmidos y se optimizaron las condiciones de transfección utilizando métodos matemáticos.[6] Se preparó la mezcla del complejo de transfección y se dejó reposar durante un breve periodo de tiempo antes de añadir medio fresco. Se desechó el medio antiguo de los recipientes de comparación, se añadió la mezcla de transfección y se incubaron los recipientes en condiciones controladas. Se recogieron los sobrenadantes y se añadieron medios frescos a las 48h y a las 72h, y se combinaron los extractos. Las poblaciones celulares 293T en crecimiento se sembraron en placas de 12 pocillos, se incubaron y se añadió el sobrenadante que contenía LV. Tras incubación adicional, se cuantificaron los títulos de LV mediante análisis de clasificación celular activada por fluorescencia (Figura 1).
Tras la producción y titulación, el recipiente HYPERStack™ de 12 capas alcanzó rendimientos de 2,9 x 107 TU/mL y 1,2 x 107 TU/cm2, en los que el título total alcanzó 7,5 x 1010 TU. Los volúmenes unitarios y los rendimientos de área de los matraces CellSTACK™ de 2 capas y T-25 fueron inferiores (Figura 2).
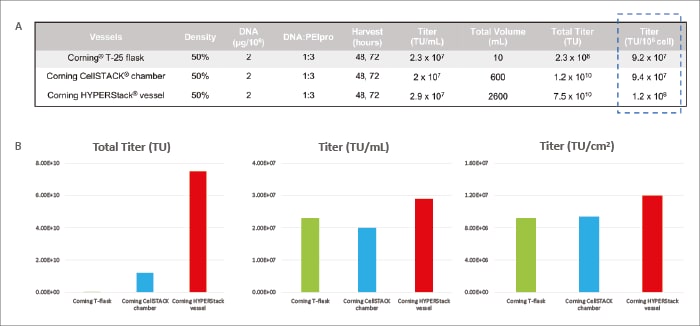
"El recipiente Corning™ HYPERStack™ se comparó con los recipientes de cultivo tradicionales, lo que reveló que el recipiente HYPERStack™ puede producir un título de LV superior."
Ventajas de Corning™ HYPERStack™
El recipiente de cultivo celular Corning™ HYPERStack™ combina lo mejor de dos productos: los recipientes de cultivo celular Corning™ CellSTACK™ e HYPERFlask™.[7] La tecnología HYPER cuenta con una película exclusiva y ultrafina permeable a los gases para eliminar el espacio de aire dentro del recipiente. El resultado es un aumento sustancial de la superficie de crecimiento celular en comparación con los recipientes tradicionales de capas apiladas de tamaño cúbico comparable. La utilización de la tecnología HYPER en la huella espacial del CellSTACK™ proporciona un recipiente de cultivo celular eficiente y escalable para el cultivo de células adherentes.
Desde la producción de vacunas de vectores virales hasta la terapia con células madre, los recipientes Corning™ HYPERStack™ ofrecen muchas ventajas, entre las que se incluyen:
- Mayores rendimientos celulares totales: hasta 5 veces la superficie de crecimiento de un recipiente de cultivo celular tradicional de huella comparable
- Morfología celular, fenotipo y crecimiento similares en comparación con los recipientes tradicionales
- Diseño de sistema cerrado ideal para células a gran escala, terapéutica de proteínas, terapia de células madre, vesículas extracelulares, vacunas y producción de virus, incluidos los dirigidos a COVID-19
- Producto escalable con múltiples ofertas de tamaño para soportar el escalado y la ampliación
- Montaje innovador y diseño ergonómico
- Menos desperdicio volumétrico - ofrece un volumen de medio fijo de 0,2 mL/cm2 llena
Matthew Weston es un especialista en contenidos de Fisher Scientific UK.
Preguntas frecuentes
Referencias
[1] Xiaofan T, Rui C. Transfección transitoria a gran escala para la producción de vectores lentivirales utilizando el recipiente de cultivo celular Corning™ HYPERStack™: Nota de aplicación. Corning Inc. 2022. https://www.corning.com/catalog/cls/documents/application-notes/CLS-AN-669.pdf.
[2] Milone MC, O'Doherty U. Uso clínico de vectores lentivirales. Leukemia 2018; 32: 1529-1541. Doi: 10.1038/s41375-018-0106-0.
[3] Southey F. Oxford BioMedica capturará el 25-30% del mercado de vectores lentivirales para 2026, predice CTO. Dec 10, 2018. Obtenido de www.biopharma-reporter.com/Article/2018/12/10/Oxford-BioMedicato-capture-25-30-of-lentiviral-vector-market-by-2026-predicts-CTO.
[4] Cavazzana-Calvo M, et al. Independencia de la transfusión y activación de HMGA2 tras la terapia génica de la ß-talasemia humana. Nature 2010; 467: 318-322. Doi: 10.1038/nature09328.
[5] Palfi S, et al. Long-Term Safety and Tolerability of ProSavin, a Lentiviral Vector-Based Gene Therapy for Parkinson's Disease: A Dose Escalation, Open-Label, Phase 1/2 Trial. Lancet 2014; 383: 1138-1146. Doi: 10.1016/S0140-6736(13)61939-X.
[6] Yuan W, Chen J, et al. Análisis comparativo y optimización de protocolos para producir lentivirus recombinantes portadores del gen receptor de antígeno quimérico anti-Her2. J Gene Med 2018; 20(7-8): e3027. Doi: 10.1002/jgm.3027.
[7] Recipientes de cultivo celular Corning™ HYPERStack™: Multiply Your Cells, Not Your Work (Multiplique sus células, no su trabajo). Corning Inc. 2023. www.corning.com/emea/en/products/life-sciences/products/bioprocess/hyper-platforms/hyperstack-platform.html.